PH計測量原理
文章出處:煜凡發表時間:2017-1-18 10:02:10
瀏覽數:
PH計是一種常用的儀器設備,主要用于測量液體中的氫離子濃度,得出酸性、中性還是堿性的數值。主要應用于環保、污水處理、醫藥、化工等領域。pH計的全量程為0~14pH,pH=7為中性,pH<7為酸性,pH值接近0為強酸性,pH>7為堿性,pH值接近14為強堿性。
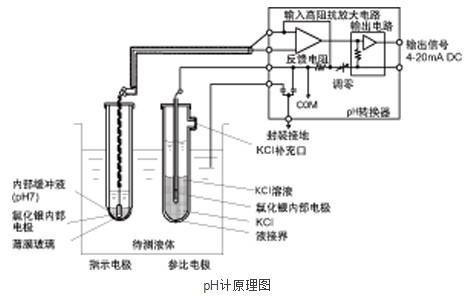

上圖所示的是普通PH計的原理和結構,目前pH計上配套使用的電極大多數采用復合電極,復合電極也就是我們所說的指示電極和參比電極。將待測液體氫離子活性作為兩根電極之間產生的電位差,通過變送器得到傳輸信號。成為基準的電極被稱為玻璃電極,從外觀來看與玻璃試管相似。但是前端為特殊玻璃制成的數十微米的薄膜玻璃,內置有內部緩沖液和內部電極。內部電極與待測液體之間有玻璃薄膜,基本上是絕緣狀態。另一端的電極成為比較電極(或參比電極),結構與玻璃電極類似,但前段那有液接界,內部液體與待測液體通過縫隙接觸,液接界形態多樣,包括玻璃纖維形、小孔形、陶瓷形、套管形等,根據具體用途進行選擇。
測量液的氫離子活性會使玻璃電極的薄膜玻璃兩側之間產生電位差,玻璃電極的薄膜玻璃內側電位經過內部緩沖液,通過內電極導出;而接液的外側電位經過待測液體-參比電極液接界-內部液體,通過參比電極的內部電極導出。兩電極的內部電極與內部液體之間產生的電位,大體相互抵消,所以能測量薄膜玻璃兩側的電位。
理論上,0~7~14pH的發生電位差在25℃時為414mV~0~-414mV左右。在能斯特方程式中,電位差大約會變化-59 mV,但實際上1pH的變化大約會變化-58 mV,此外對于強酸性與強堿性,由于玻璃膜的材質以及液體的種類不同,會產生誤差。pH計的校正使用符合JIS標準的pH標準液。pH標準液包括草酸鹽、鈦酸鹽、中性磷酸鹽、磷酸鹽、硼酸鹽、碳酸鹽。
相關推薦:ph計
- 聯系我們
-
- 全國統一服務熱線
400-086-0510- 企業郵箱
251677379@qq.com - 全國統一服務熱線



 全國銷售熱線:400-086-0510
全國銷售熱線:400-086-0510




